Ei galera aqui está algumas questões de química para vocês testarem um pouco seus conhecimentos:
Configuração Eletrônica:
Questões:
01. (ACAFE) Considerando-se um elemento M genérico qualquer, que apresenta configuração eletrônica 1s2 2s2 2p6 3s2 3p6 4s2 3d5, pode-se afirmar que:
I. seu número atômico é 25;
II. possui 7 elétrons na última camada;
III. apresenta 5 elétrons desemparelhados;
IV. pertencem a família 7A.
Estão corretas as afirmações:
a) I, II e III somente
b) I e III somente
c) II e IV somente
d) I e IV somente
e) II, III e IV somente
02. (UFSC) O número de elétrons em cada subnível do átomo estrôncio (38Sr) em ordem crescente de energia é:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
03. (ABC) De acordo com e regra de Hund, estrutura eletrônica do átomo de carbono, no estado fundamental, é representada por:
a) 1s2 2s2 3p2
04. Conceitue orbital de um elétron.
05. Indique a distribuição eletrônica do oxigênio (Z = 8) no estado fundamental.
06. (ITA) O número máximo de orbitais atômicos correspondente ao número quântico principal é:
a) n
b) 2n
c) 2n + 1
d) n2
e) 2n2
07. (CESCEM) Qual dos valores abaixo pode representar o número atômico de um átomo que, no estado fundamental, apresenta apenas dois elétrons de valência?
a) 16
b) 17
c) 18
d) 19
e) 20
08. (FUVEST) Em um átomo, quantos elétrons podem ocupar o orbital p representado na figura?
a) 2
b) 3
c) 4
d) 5
e) 6
09. (PUC) O número normal de subníveis existentes no quarto nível energético dos átomos é igual a:
a) 1
b) 2
c) 3
d) 4
e) 5
10. (OSEC) Sendo o subnível 4s1 (com um elétron) o mais energético de um átomo, podemos afirmar que:
I. o número total de elétrons desse átomo é igual a 19;
II. esse apresenta quatro camadas eletrônicas;
III. a sua configuração eletrônica é 1s2 2s2 2p6 3s2 3p6 3d10 4s1
a) Apenas a firmação I é correta.
b) Apenas a firmação II é correta.
c) Apenas a firmação III é correta.
d) As afirmações I e II são corretas.
e) As afirmações II e III são corretas.
Resolução:
01. B
02. A
03. B
04. É a região de maior probabilidade para localizarmos um elétron.
05. O estado fundamental é aquele em que cada elétron está na situação de menor energia permitida.
Seguindo o diagrama de Pauling, para o átomo de oxigênio, que apresenta 8 elétrons, temos: 1s2 2s2 2p4
06. D
07. E
08. A
09. D
10. D
Isótonos, Isóbaros e Isótopos
Questões:
01. (ABC) O deutério é um:
a) Isóbaro de hidrogênio.
b) Isótopo de hidrogênio.
c) Radioisótono do hidrogênio.
d) Isômero do hidrogênio.
e) Alótropo do hidrogênio.
a) Isóbaro de hidrogênio.
b) Isótopo de hidrogênio.
c) Radioisótono do hidrogênio.
d) Isômero do hidrogênio.
e) Alótropo do hidrogênio.
a) isótopos.
b) alótropos.
c) isóbaros.
d) isômeros.
e) isótopos.
03. (ITA) São definidas quatro espécies de átomos neutros em termos de partículas nucleares:
Átomo I – possui 18 prótons e 21 nêutrons
Átomo II – possui 19 prótons e 20 nêutrons
Átomo III – possui 20 prótons e 19 nêutrons
Átomo IV – possui 20 prótons e 20 nêutrons
Pode-se concluir que:
a) os átomos III e IV são isóbaros;
b) os átomos II e III são isoeletrônicos;
c) os átomos II e IV são isótopos;
d) os átomos I e II pertencem ao mesmo período da Classificação Periódica;
e) os átomos II e III possuem o mesmo número de massa.
04. (MACK) Assinale a alternativa incorreta:
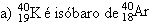
b) Isótopos são átomos de diferentes números atômicos e iguais número de nêutrons.

d) Isótonos são átomos de elementos diferentes e iguais número de nêutrons.
e) n.d.a.
05. (PUC-RIO) Os isótopos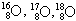 possuem respectivamente os seguintes números de nêutrons:
possuem respectivamente os seguintes números de nêutrons:
a) 8, 8, 8
b) 8, 9, 10
c) 16, 17, 18
d) 24, 25, 26
e) 18, 17, 16
06. (PUC – RIO) Os fenômenos isotopia, isobaria e alotropia são representados respectivamente pelos exemplos:
isótopos isóbaros alótropos
a) O2; O3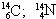
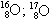
b)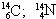
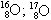 O2; O3
O2; O3
c) O2; O3
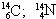
d) O2; O3
O2; O3 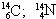
e)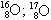
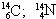 O2; O3
O2; O3
07. Têm-se os seguintes átomos e íons genéricos: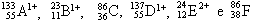
São, respectivamente, isoeletrônicos, isótopos, isóbaros, isótonos e pertencem ao mesmo elemento químico os seguintes pares:
a) B1+ e E2+ / A e D / C e F / B e E / A e D
b) B1+ + E2+ / C e F / A e D / C e B / B e D
c) A1+ + F / B e C / C e E / B e D / A e D
d) A1+ e E2+ / A e D / C e F / B e E / A e D
e) C e F / A e D / B e E / A e F / B e C
Resolução:
b) alótropos.
c) isóbaros.
d) isômeros.
e) isótopos.
03. (ITA) São definidas quatro espécies de átomos neutros em termos de partículas nucleares:
Átomo I – possui 18 prótons e 21 nêutrons
Átomo II – possui 19 prótons e 20 nêutrons
Átomo III – possui 20 prótons e 19 nêutrons
Átomo IV – possui 20 prótons e 20 nêutrons
Pode-se concluir que:
a) os átomos III e IV são isóbaros;
b) os átomos II e III são isoeletrônicos;
c) os átomos II e IV são isótopos;
d) os átomos I e II pertencem ao mesmo período da Classificação Periódica;
e) os átomos II e III possuem o mesmo número de massa.
04. (MACK) Assinale a alternativa incorreta:
b) Isótopos são átomos de diferentes números atômicos e iguais número de nêutrons.
d) Isótonos são átomos de elementos diferentes e iguais número de nêutrons.
e) n.d.a.
05. (PUC-RIO) Os isótopos
a) 8, 8, 8
b) 8, 9, 10
c) 16, 17, 18
d) 24, 25, 26
e) 18, 17, 16
06. (PUC – RIO) Os fenômenos isotopia, isobaria e alotropia são representados respectivamente pelos exemplos:
isótopos isóbaros alótropos
a) O2; O3
b)
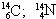
c) O2; O3
d)
e)
07. Têm-se os seguintes átomos e íons genéricos:
São, respectivamente, isoeletrônicos, isótopos, isóbaros, isótonos e pertencem ao mesmo elemento químico os seguintes pares:
a) B1+ e E2+ / A e D / C e F / B e E / A e D
b) B1+ + E2+ / C e F / A e D / C e B / B e D
c) A1+ + F / B e C / C e E / B e D / A e D
d) A1+ e E2+ / A e D / C e F / B e E / A e D
e) C e F / A e D / B e E / A e F / B e C
Resolução:
| 01. B | 02. C | 03. E | 04. B |
| 05. B | 06. E | 07. A |
Leis das Combinações Químicas
Questões:
01. (ITA) A observação experimental de que 1,20g de carbono pode se combinar tanto com 1,60g de oxigênio como com 3,20g de oxigênio corresponde a uma confirmação da:
a) Lei da Conservação das Massas, de Lavoisier;
b) Lei de Guldberg e Waage;
c) Regra de Proust, sobre pesos atômicos;
d) Lei das Proporções Múltiplas, de Dalton;
e) Lei das Proporções Recíprocas, de Richter e Wenzel.
02. Numa primeira experiência, colocando-se 2,4g de magnésio em presença de 9,1g de cloro, verifica-se a formação de 9,5g de cloreto de magnésio com um excesso de 2g de cloro. Numa Segunda experiência, adicionando-se 5g de magnésio a 14,2g de cloro, formam-se 19g de cloreto de magnésio com 0,2g de magnésio em excesso. Verificar se os resultados estão de acordo com a Lei de Lavoisier e de Proust.
03. Na reação equacionada X + Y ® XY, a razão entre as massas de X e Y é de 0,5.
Ao se adicionarem 30,0g de X a 90,0g de Y, obtêm-se 90,0g de produto XY. Pode-se dizer que:
a) há excesso de 30,0g de Y;
b) a Lei de Lavoisier não foi obedecida;
c) a Lei de Prost não foi obedecida;
d) há excesso de 15,0g de X;
e) reagiram 20,0g de X e 70,0g de Y.
04. De acordo com a Lei de Lavoisier, quando fizermos reagir completamente, em ambiente fechado, 1,12g de ferro com 0,64g de enxofre, a massa, em gramas, de sulfeto de ferro obtido será de:
Dados: Fe = 56 u; S = 32 u
a) 2,76
b) 2,24
c) 1,76
d) 1,28
e) 0,48
05. Na reação dada pela equação A + B → C, a razão entre as massas de A e B é 0,4. Se 8g de A forem adicionados a 25g de B, após a reação, verificar-se-á:
a) a formação de 20g de C, havendo excesso de 13g de B.
b) um excesso de 5g de B e consumo total da massa de A colocada.
c) o consumo total das massas de A e B colocadas.
d) a formação de 18g de C, havendo excesso de 5g de A.
e) um excesso de 4,8g de A e consumo total da massa de B colocada.
Resolução:
01. D
a) Lei da Conservação das Massas, de Lavoisier;
b) Lei de Guldberg e Waage;
c) Regra de Proust, sobre pesos atômicos;
d) Lei das Proporções Múltiplas, de Dalton;
e) Lei das Proporções Recíprocas, de Richter e Wenzel.
02. Numa primeira experiência, colocando-se 2,4g de magnésio em presença de 9,1g de cloro, verifica-se a formação de 9,5g de cloreto de magnésio com um excesso de 2g de cloro. Numa Segunda experiência, adicionando-se 5g de magnésio a 14,2g de cloro, formam-se 19g de cloreto de magnésio com 0,2g de magnésio em excesso. Verificar se os resultados estão de acordo com a Lei de Lavoisier e de Proust.
03. Na reação equacionada X + Y ® XY, a razão entre as massas de X e Y é de 0,5.
Ao se adicionarem 30,0g de X a 90,0g de Y, obtêm-se 90,0g de produto XY. Pode-se dizer que:
a) há excesso de 30,0g de Y;
b) a Lei de Lavoisier não foi obedecida;
c) a Lei de Prost não foi obedecida;
d) há excesso de 15,0g de X;
e) reagiram 20,0g de X e 70,0g de Y.
04. De acordo com a Lei de Lavoisier, quando fizermos reagir completamente, em ambiente fechado, 1,12g de ferro com 0,64g de enxofre, a massa, em gramas, de sulfeto de ferro obtido será de:
Dados: Fe = 56 u; S = 32 u
a) 2,76
b) 2,24
c) 1,76
d) 1,28
e) 0,48
05. Na reação dada pela equação A + B → C, a razão entre as massas de A e B é 0,4. Se 8g de A forem adicionados a 25g de B, após a reação, verificar-se-á:
a) a formação de 20g de C, havendo excesso de 13g de B.
b) um excesso de 5g de B e consumo total da massa de A colocada.
c) o consumo total das massas de A e B colocadas.
d) a formação de 18g de C, havendo excesso de 5g de A.
e) um excesso de 4,8g de A e consumo total da massa de B colocada.
Resolução:
01. D
02. Mg + Cl2 → MgCl2 + excesso
2,4g 9,1g 9,5g 2,0g de Cl2
5,0g 14,2g 19,0g 0,2g de Mg
Lei de Lavoisier: Lei da Conservação das Massas que efetivamente reagem.
2,4g 9,1g 9,5g 2,0g de Cl2
5,0g 14,2g 19,0g 0,2g de Mg
Lei de Lavoisier: Lei da Conservação das Massas que efetivamente reagem.
Logo: Mg + Cl2 → MgCl2
2,4g 7,1g 9,5g
4,8g 14,2g 19g
2,4g 7,1g 9,5g
4,8g 14,2g 19g
As experiências obedecem a Lei de Lavoisier.
| 03. A | 04. C | 05. B |











0 comentários:
Postar um comentário