Introdução
Química é a ciência que estuda a estrutura das substâncias, a composição e as propriedades das diferentes matérias, suas transformações e variações de energia.
Ela conquistou um lugar central e essencial em todos os assuntos do conhecimento humano. Relaciona-se com outras ciências como a Biologia, Ciências Ambientais, Física, Medicina e Ciências da Saúde.
A Química é útil em inúmeras atividades, como, por exemplo, na agricultura, onde os agricultores a utilizam para melhorar a acidez do sol. Os médicos também precisam do conhecimento químico para reconhecer a composição das substâncias utilizadas como medicamento.
A Química é uma ciência experimental que teve seu processo de descoberta ligado à preocupação que as culturas antigas tinham em compreender a relação entre o ser humano, a natureza e seus fenômenos: a chamada Alquimia.
A Alquimia é uma prática ancestral, a antiga química exercitada na Era Medieval. Ela une em seu amplo espectro cognitivo noções de química, física, astrologia, arte, metalurgia, medicina, misticismo e religião. A crença mais difundida é a de que os alquimistas buscam encontrar na Pedra Filosofal, mítica substância, o poder de transformar tudo em ouro e, mais ainda, de proporcionar a quem a encontrar, a vida eterna e a cura de todos os males.

Segundo os pesquisadores, porém, a Alquimia vai além. Suas metas têm um valor simbólico, o que significa que na verdade seus praticantes visam algo maior – a transmutação espiritual. Assim sendo, o famoso Elixir da Longa Vida nada mais seria que um recurso próprio do organismo humano, capaz de conceder àqueles que realizam o longo processo de purificação espiritual uma vida dilatada ao infinito. Afirma-se que esta substância é também um ponto importante na filosofia da Yoga.
Os alquimistas procuravam intensificar a busca deste Elixir através de experiências laboratoriais que utilizavam os quatro elementos, essenciais nos trabalhos alquímicos: fogo, água, terra e ar. Na observação extrema da Natureza e de seus componentes, os alquimistas alcançaram conhecimentos muito importantes, alguns deles só recentemente retomados pela Física Quântica, como a evidência de que todas as coisas se encontram interconectadas no Cosmos. Esta visão holística contribuiu muito para as curas realizadas pelo médico suíço Philippus Paracelsus, que em sua missão de curador partia deste ponto de vista. Ele acreditava que substâncias como o sal, o mercúrio e o enxofre permeiam todos os seres vivos, até mesmo o organismo humano.
Atualmente, esta mesma crença é resgatada pela Antroposofia, corrente espiritualista que também compara conceitos da Alquimia com forças ativas da alma – o pensamento corresponderia ao sal; o sentimento ao mercúrio e o desejo ao enxofre. Alguns de seus pensadores vêem o ouro perseguido pelos alquimistas como uma representação do ‘self’, a essência humana.
Embora a Alquimia não seja atualmente considerada uma Ciência, tal como o conhecimento científico é hoje concebido, e sim uma visão espiritual mais preocupada com antigas tradições do que com a descoberta de novidades, ela é considerada uma ancestral da Química moderna e da própria Medicina. Além das experiências químicas de que se ocupavam os alquimistas, havia a constante preocupação com a realização de uma série de ritos.

A Alquimia lidava igualmente com alguns pontos da Cabala e da Magia, além de cultivar uma filosofia hermética. Da teoria cabalística a Alquimia herdou a busca da harmonia dos contrários. A Pedra Filosofal poderia ser, portanto, a procura da perfeição, que não poderia ser alcançada sem o equilíbrio entre as polaridades de que o Homem se reveste. Portanto, a manipulação dos metais seria um símbolo da metamorfose espiritual pela qual passa cada um dos seres vivos. Mas muitas são as interpretações dos textos alquímicos, e até hoje não se chegou a um consenso sobre o real significado dos símbolos da Alquimia.
Acompanhe os exemplos de distribuição eletrônica:
1 - Distribuir os elétrons do átomo normal de manganês (Z=25) em ordem de camada.
Solução:
Se Z=25 isto significa que no átomo normal de manganês há 25 elétrons. Aplicando o diagrama de Pauling, teremos:
K - 1s2
L - 2s2 2p6
M - 3s2 3p6 3d5
N - 4s2 4p 4d 4f
Resposta: K=2; L=8; M=13; N=2
2 - Distribuir os elétrons do átomo normal de xenônio (Z=54) em ordem de camada.
Solução:
K - 1s2
L - 2s2 2p6
M- 3s2 3p6 3d10
N- 4s2 4p6 4d10 4f
Resposta: K=2; L=8; M=18; N=18; O=8
Há alguns elementos químicos cuja distribuição eletrônica não “bate” com o diagrama de Pauling.

Diferentes substâncias apresentam diferentes comportamentos quando colocadas na presença de um solvente. Algumas se dissolvem, outras não. Dentre aquelas que dissolvem, dois processos são bastante importantes: dissociação e ionização (dê uma uma lida nos textos Ligações Químicas e Solubilidade em Água para entender melhor do que vamos falar).
A dissociação e ionização resultam em soluções que possuem uma característica comum: liberam íons na água, mas a origem desses íons é que diferencia um processo do outro.
Ligações iônicas ou molecularesComo sabemos, as substâncias são formadas por moléculas e estas moléculas por átomos. A forma com que os átomos se ligam entre si é que varia podendo ser de forma iônica ou molecular. Quando as ligações são iônicas um átomo (ou grupo de átomos) transferiu de forma definitiva um ou mais elétrons de seu ligante para si, tornando-se um íon negativo e transformando o outro em íon positivo.
Um fica perto do outro por atração magnética. Nas ligações moleculares ou covalentes, os elétrons são compartilhados entre os ligantes e não há íons previamente formados. Compostos iônicos, ou seja, formados por ligações iônicas, já possuem íons e, quando colocados na presença de um solvente, ou quando fundidos - em estado líquido - separam os íons positivos dos negativos, seja pela solvatação promovida pelo solvente ou simplesmente pelo aumento da distância intermolecular.
Dissociação iônicaNesse caso, em que já existiam íons e apenas os separamos, chamamos o processo de dissociação iônica, pois tudo o que fizemos, repito, foi separar íons pré-existentes. É o que acontece com os sais e as bases.
NaCl = Na+ + Cl-
Importante: Compostos iônicos sofrem dissociação quando em solução e quando fundidos.
IonizaçãoAlguns compostos moleculares, como os ácidos, quando colocados em um solvente são "atacados" por esse solvente e acabam formando íons. Perceba claramente que não existiam íons na molécula original. Quando ela foi colocada na presença do solvente, este conseguiu, por força magnética, "arrancar" um ou mais de seus átomos mas, nesse processo, o átomo arrancado acaba tendo que deixar um elétron para trás, tornando-se um íon.
Nesses casos, dizemos que houve uma ionização, pois uma molécula que não possuía originalmente íons passa a tê-los (livres no solvente). É o que acontece com os ácidos.
HCl = H+ + Cl-
Importante: Substâncias moleculares que sofrem ionização só o fazem quando em solução. O processo não ocorre quando essas substâncias estão fundidas.
O que você deve lembrar
Sais e bases: por serem compostos iônicos, sofrem dissociação quando em solução ou fundidos.
Ácidos: por serem compostos moleculares, sofrem ionização quando em solução.
A dissociação ou ionização é de grande importância para o favorecimento da ocorrência de reações. É muito mais fácil promovermos reações com íons livres do que com moléculas agrupadas. Talvez seja por isso que, na sábia natureza, a esmagadora maioria das reações químicas - inclusive no nosso corpo - aconteçam em solução. Além disso, íons livres permitem a passagem de corrente elétrica, o que, em casos como neurotransmissores é absolutamente fundamental.
Estude um pouco
* Fábio Rendelucci é professor de química e física e diretor do cursinho COC-Universitário de Santos (SP).
Ela conquistou um lugar central e essencial em todos os assuntos do conhecimento humano. Relaciona-se com outras ciências como a Biologia, Ciências Ambientais, Física, Medicina e Ciências da Saúde.
A Química é útil em inúmeras atividades, como, por exemplo, na agricultura, onde os agricultores a utilizam para melhorar a acidez do sol. Os médicos também precisam do conhecimento químico para reconhecer a composição das substâncias utilizadas como medicamento.
A Química é uma ciência experimental que teve seu processo de descoberta ligado à preocupação que as culturas antigas tinham em compreender a relação entre o ser humano, a natureza e seus fenômenos: a chamada Alquimia.
História da Alquimia
A Alquimia é uma prática ancestral, a antiga química exercitada na Era Medieval. Ela une em seu amplo espectro cognitivo noções de química, física, astrologia, arte, metalurgia, medicina, misticismo e religião. A crença mais difundida é a de que os alquimistas buscam encontrar na Pedra Filosofal, mítica substância, o poder de transformar tudo em ouro e, mais ainda, de proporcionar a quem a encontrar, a vida eterna e a cura de todos os males.

Segundo os pesquisadores, porém, a Alquimia vai além. Suas metas têm um valor simbólico, o que significa que na verdade seus praticantes visam algo maior – a transmutação espiritual. Assim sendo, o famoso Elixir da Longa Vida nada mais seria que um recurso próprio do organismo humano, capaz de conceder àqueles que realizam o longo processo de purificação espiritual uma vida dilatada ao infinito. Afirma-se que esta substância é também um ponto importante na filosofia da Yoga.
Os alquimistas procuravam intensificar a busca deste Elixir através de experiências laboratoriais que utilizavam os quatro elementos, essenciais nos trabalhos alquímicos: fogo, água, terra e ar. Na observação extrema da Natureza e de seus componentes, os alquimistas alcançaram conhecimentos muito importantes, alguns deles só recentemente retomados pela Física Quântica, como a evidência de que todas as coisas se encontram interconectadas no Cosmos. Esta visão holística contribuiu muito para as curas realizadas pelo médico suíço Philippus Paracelsus, que em sua missão de curador partia deste ponto de vista. Ele acreditava que substâncias como o sal, o mercúrio e o enxofre permeiam todos os seres vivos, até mesmo o organismo humano.
Atualmente, esta mesma crença é resgatada pela Antroposofia, corrente espiritualista que também compara conceitos da Alquimia com forças ativas da alma – o pensamento corresponderia ao sal; o sentimento ao mercúrio e o desejo ao enxofre. Alguns de seus pensadores vêem o ouro perseguido pelos alquimistas como uma representação do ‘self’, a essência humana.
Embora a Alquimia não seja atualmente considerada uma Ciência, tal como o conhecimento científico é hoje concebido, e sim uma visão espiritual mais preocupada com antigas tradições do que com a descoberta de novidades, ela é considerada uma ancestral da Química moderna e da própria Medicina. Além das experiências químicas de que se ocupavam os alquimistas, havia a constante preocupação com a realização de uma série de ritos.

A Alquimia lidava igualmente com alguns pontos da Cabala e da Magia, além de cultivar uma filosofia hermética. Da teoria cabalística a Alquimia herdou a busca da harmonia dos contrários. A Pedra Filosofal poderia ser, portanto, a procura da perfeição, que não poderia ser alcançada sem o equilíbrio entre as polaridades de que o Homem se reveste. Portanto, a manipulação dos metais seria um símbolo da metamorfose espiritual pela qual passa cada um dos seres vivos. Mas muitas são as interpretações dos textos alquímicos, e até hoje não se chegou a um consenso sobre o real significado dos símbolos da Alquimia.
Distribuição Eletrônica
Os elétrons estão distribuídos em camadas ao redor do núcleo. Admite-se a existência de 7 camadas eletrônicas, designados pelas letras maiúsculas:
K,L,M,N,O,P e Q. À medida que as camadas se afastam do núcleo, aumenta a energia dos elétrons nelas localizados.
As camadas da eletrosfera representam os níveis de energia da eletrosfera. Assim, as camadas K,L,M,N,O, P e Q constituem os 1º, 2º, 3º, 4º, 5º, 6º e 7º níveis de energia, respectivamente.
Por meio de métodos experimentais, os químicos concluíram que o número máximo de elétrons que cabe em cada camada ou nível de energia é:
K,L,M,N,O,P e Q. À medida que as camadas se afastam do núcleo, aumenta a energia dos elétrons nelas localizados.
As camadas da eletrosfera representam os níveis de energia da eletrosfera. Assim, as camadas K,L,M,N,O, P e Q constituem os 1º, 2º, 3º, 4º, 5º, 6º e 7º níveis de energia, respectivamente.
Por meio de métodos experimentais, os químicos concluíram que o número máximo de elétrons que cabe em cada camada ou nível de energia é:
| Nível de energia | Camada | Número máximo de elétrons |
| 1º | K | 2 |
| 2º | L | 8 |
| 3º | M | 18 |
| 4º | N | 32 |
| 5º | O | 32 |
| 6º | P | 18 |
| 7º | Q | 2 (alguns autores admitem até 8) |
Em cada camada ou nível de energia, os elétrons se distribuem em subcamadas ou subníveis de energia, representados pelas letras s,p,d,f, em ordem crescente de energia.
O número máximo de elétrons que cabe em cada subcamada, ou subnivel de energia, também foi determinado experimentalmente:
O número máximo de elétrons que cabe em cada subcamada, ou subnivel de energia, também foi determinado experimentalmente:
energia crescente
---------------------------------->
---------------------------------->
| Subnível | s | p | d | f |
| Número máximo de elétrons | 2 | 6 | 10 | 14 |
O número de subníveis que constituem cada nível de energia depende do número máximo de elétrons que cabe em cada nível. Assim, como no 1ºnível cabem no máximo 2 elétrons, esse nível apresenta apenas um subnível s, no qual cabem os 2 elétrons. O subnível s do 1º nível de energia é representado por 1s.
Como no 2º nível cabem no máximo 8 elétrons, o 2º nível é constituído de um subnível s, no qual cabem no máximo 2 elétrons, e um subnível p, no qual cabem no máximo 6 elétrons. Desse modo, o 2º nível é formado de dois subníveis, representados por 2s e 2p, e assim por diante.
Como no 2º nível cabem no máximo 8 elétrons, o 2º nível é constituído de um subnível s, no qual cabem no máximo 2 elétrons, e um subnível p, no qual cabem no máximo 6 elétrons. Desse modo, o 2º nível é formado de dois subníveis, representados por 2s e 2p, e assim por diante.
Resumindo:
| Nível | Camada | Nº máximo de elétrons | Subníveis conhecidos |
| 1º | K | 2 | 1s |
| 2º | L | 8 | 2s e 2p |
| 3º | M | 18 | 3s, 3p e 3d |
| 4º | N | 32 | 4s, 4p, 4d e 4f |
| 5º | O | 32 | 5s, 5p, 5d e 5f |
| 6º | P | 18 | 6s, 6p e 6d |
| 7º | Q | 2 (alguns autores admitem até 8) | 7s 7p |
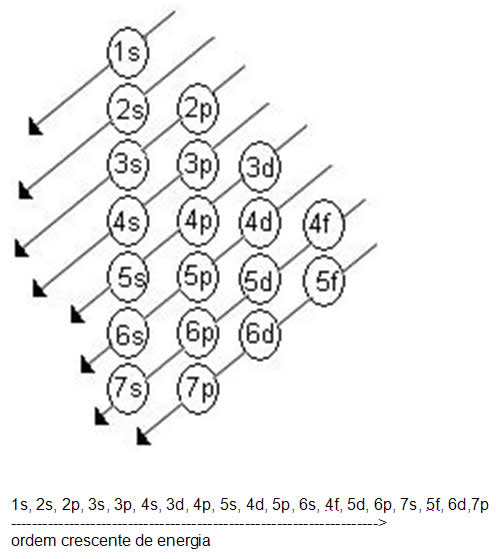
Linus Carl Pauling (1901-1994), químico americano, elaborou um dispositivo prático que permite colocar todos os subníveis de energia conhecidos em ordem crescente de energia. É o processo das diagonais, denominado diagrama de Pauling, representado a seguir. A ordem crescente de energia dos subníveis é a ordem na sequência das diagonais.

Acompanhe os exemplos de distribuição eletrônica:
1 - Distribuir os elétrons do átomo normal de manganês (Z=25) em ordem de camada.
Solução:
Se Z=25 isto significa que no átomo normal de manganês há 25 elétrons. Aplicando o diagrama de Pauling, teremos:
K - 1s2
L - 2s2 2p6
M - 3s2 3p6 3d5
N - 4s2 4p 4d 4f
O - 5s 5p 5d 5f
P - 6s 6p 6d
Q - 7s 7p
Resposta: K=2; L=8; M=13; N=2
2 - Distribuir os elétrons do átomo normal de xenônio (Z=54) em ordem de camada.
Solução:
K - 1s2
L - 2s2 2p6
M- 3s2 3p6 3d10
N- 4s2 4p6 4d10 4f
O- 5s2 5p6 5d 5f
P- 6s 6p 6d
Q- 7s 7p
Resposta: K=2; L=8; M=18; N=18; O=8
Há alguns elementos químicos cuja distribuição eletrônica não “bate” com o diagrama de Pauling.
Ligações Químicas
Teoria do octeto

Na natureza, todos os sistemas tendem a adquirir a maior estabilidade possível. Os átomos ligam-se uns aos outros para aumentar a sua estabilidade. Os gases nobres são as únicas substâncias formadas por átomos isolados.
Conclusão: os átomos dos gases nobres são os únicos estáveis.
Os átomos dos gases nobres são os únicos que possuem a camada da valência completa, isto é, com oito elétrons (ou dois, no caso da camada K).
Conclusão: a saturação da camada da valência com oito elétrons (ou dois, no caso da camada K) aumenta a estabilidade do átomo.
A configuração eletrônica com a camada da valência completa é chamada configuração estável. Os átomos dos gases nobres são os únicos que já têm a camada da valência completa.
Teoria do octeto - Os átomos dos elementos ligam-se uns aos outros na tentativa de completar a camada da valência de seus átomos. Isso pode ser conseguido de diversas maneiras, dando origem a diversos tipos de Ligação Química.
Ligação Química
Ligação iônica ou eletrovalente é a atração eletrostática entre íons de cargas opostas num retículo cristalino. Esses íons formam-se pela transferência de elétrons dos átomos de um elemento para os átomos de outro elemento.
Para se formar uma ligação iônica, é necessário que os átomos de um dos elementos tenham tendência a ceder elétrons e os átomos do outro elemento tenham tendência a receber elétrons.
Para se formar uma ligação iônica, é necessário que os átomos de um dos elementos tenham tendência a ceder elétrons e os átomos do outro elemento tenham tendência a receber elétrons.
Quando os átomos de dois elementos A e B têm ambos tendência a ceder ou a receber elétrons, não pode se formar uma ligação iônica entre eles.
Os átomos com tendência a ceder elétrons apresentam um, dois ou três elétrons na camada da valência; são todos átomos de metais, com exceção dos átomos de H e He. Os átomos com tendência a receber elétrons apresentam quatro, cinco, seis e sete elétrons na camada da valência; são os átomos dos não-metais e do H.
Uma ligação iônica forma-se entre um metal e um não-metal ou entre um metal e o H. Os elétrons são transferidos dos átomos dos metais para os dos não-metais ou do H.
Os átomos dos metais, cedendo elétrons, transformam-se em íons positivos ou cátions, e os átomos dos não-metais ou do H, recebendo elétrons, transformam-se em íons negativos ou ânions.
Todo ânion monoatômico tem configuração estável, semelhante à de um gás nobre, porque, na formação do ânion, o átomo recebe exatamente o número de elétrons que falta para ser atingida a configuração estável.
Nem todo cátion monoatômico tem configuração estável. O átomo, ao ceder os elétrons de sua camada da valência , nem sempre fica com configuração estável.
Os cátions dos metais alcalinos e alcalino-terrosos, bem como o cátion de alumínio, têm configurações estáveis. Os cátions dos metais de transição não têm, em sua maioria, configuração estável.
Valência é o poder de combinação dos elementos. O conceito de valência foi criado por Berzelius, em 1820.
Eletrovalência é a valência do elemento na forma iônica. É igual à carga do seu íon monoatômico.
Ligação covalente é um par de elétrons compartilhado por dois átomos, sendo um elétron de cada átomo participante da ligação.
Ligação dativa ou coordenada é um par de elétrons compartilhado por dois átomos, no qual os dois elétrons são fornecidos apenas por um dos átomos participantes da ligação. Forma-se quando um dos átomos já tem o seu octeto completo e o outro ainda não.
Ligação metálica é constituída pelos elétrons livres que ficam entre os cátions dos metais (modelo do gás eletrônico ou do mar de elétrons). Os metais são constituídos por seus cátions mergulhados em um mar de elétrons.
A ligação metálica explica a condutividade elétrica, a maleabilidade, a ductilidade e outras propriedades dos metais.
Eletronegatividade de um elemento é uma medida da sua capacidade de atrair os elétrons das ligações covalentes das quais ele participa.
Quanto maior for a capacidade de um átomo de atrair os elétrons das ligações covalentes das quais ele participa, maior será a sua eletronegatividade.
Ligação covalente polar é aquela que constitui um dipolo elétrico. Forma-se quando as eletronegatividades dos elementos ligados são diferentes.
Ligação covalente apolar é aquela que não constitui dipolo elétrico. Neste caso, as eletronegatividades dos átomos ligados são iguais.
Tipos de substâncias
Substância iônica ou eletrovalente é toda substância que apresenta pelo menos uma ligação iônica. Mesmo as substâncias que apresentam ligações iônicas e covalentes são classificadas como iônicas.
Substância molecular apresenta somente ligações covalentes e é formada por moléculas discretas.
Substância covalente apresenta somente ligações covalentes e é formada por macromoléculas.
| Propriedade das substâncias iônicas |
|---|
| Alto ponto de fusão (PF) e ponto de ebulição (PE). |
| Sólidas à temperatura ambiente. |
| Conduzem a corrente elétrica no estado fundido e não no estado sólido. |
| Cristais duros e quebradiços. |
As substâncias moleculares não apresentam as propriedades acima. As substâncias covalentes, ao contrário das moleculares, têm PF e PE altíssimos (analogia com as iônicas).
Fórmulas eletrônicas e estruturais
Estruturas de Lewis ou fórmulas eletrônicas são representações dos pares de elétrons das ligações covalentes entre todos os átomos da molécula, bem como dos elétrons das camadas da valência que não participam das ligações covalentes.
Estruturas de Couper ou fórmulas estruturais planas são representações, por traços de união, de todas as ligações covalentes entre todos os átomos da molécula.
Simples ligação é uma ligação covalente entre dois átomos (A - B).
Ligação dupla são duas ligações covalentes entre dois átomos (A = B).
Ligação tripla são três ligações covalentes entre dois átomos (A º B).
Número de oxidação
Número de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon.
O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência do elemento nesse íon.
O nox de um elemento numa molécula e num íon composto é a carga que teria o átomo desse elemento supondo que os elétrons das ligações covalentes e dativas se transferissem totalmente do átomo menos eletronegativo para o mais eletronegativo, como se fosse uma ligação iônica.
| Elementos com nox fixo em seus compostos |
|---|
| metais alcalinos (+1) |
| metais alcalino-terroso (+2) |
| alumínio (+3) |
| prata (+1) |
| zinco (+2) |
O oxigênio é o mais eletronegativo de todos os elementos, exceto o flúor. O oxigênio tem nox negativo em todos os seus compostos, exceto quando ligado ao flúor.
Na grande maioria de seus compostos, o oxigênio tem nox = -2. Nos peróxidos (grupo -O-O-) o oxigênio tem nox = -1.
O hidrogênio é menos eletronegativo que todos os não-metais e semimetais; por isso, quando ligado a esses elementos, tem nox positivo e sempre igual a +1.
O hidrogênio é mais eletronegativo que os metais; por isso, quando ligado a esses elementos, tem nox negativo e sempre igual a -1.
A soma dos nox de todos os átomos de:
Uma molécula é igual a zero.Um íon composto é igual à carga do íon.
O nox de qualquer elemento sob forma de substância simples é igual a zero.
O nox máximo de um elemento é igual ao número do grupo onde está o elemento na Tabela Periódica, com exceção dos elementos do Grupo VIIIB.
O nox mínimo é igual a (número do grupo - 8),no caso de o elemento ser um não-metal ou um semimetal.
Nox e valência - O nox de um elemento na forma de um íon monoatômico é igual à sua eletrovalência. O nox de um elemento na forma de molécula ou de íon composto não é obrigatoriamente igual à sua valência. A valência, nesses casos, é dada pelo número de ligações covalentes e dativas. Cada ligação covalente conta como uma unidade de valência, e cada ligação dativa, como duas unidades de valência.
Fonte: www.geocities.com
Ionização e Dissociação
Processos que facilitam a ocorrência de reações
Diferentes substâncias apresentam diferentes comportamentos quando colocadas na presença de um solvente. Algumas se dissolvem, outras não. Dentre aquelas que dissolvem, dois processos são bastante importantes: dissociação e ionização (dê uma uma lida nos textos Ligações Químicas e Solubilidade em Água para entender melhor do que vamos falar).
A dissociação e ionização resultam em soluções que possuem uma característica comum: liberam íons na água, mas a origem desses íons é que diferencia um processo do outro.
Ligações iônicas ou molecularesComo sabemos, as substâncias são formadas por moléculas e estas moléculas por átomos. A forma com que os átomos se ligam entre si é que varia podendo ser de forma iônica ou molecular. Quando as ligações são iônicas um átomo (ou grupo de átomos) transferiu de forma definitiva um ou mais elétrons de seu ligante para si, tornando-se um íon negativo e transformando o outro em íon positivo.
Um fica perto do outro por atração magnética. Nas ligações moleculares ou covalentes, os elétrons são compartilhados entre os ligantes e não há íons previamente formados. Compostos iônicos, ou seja, formados por ligações iônicas, já possuem íons e, quando colocados na presença de um solvente, ou quando fundidos - em estado líquido - separam os íons positivos dos negativos, seja pela solvatação promovida pelo solvente ou simplesmente pelo aumento da distância intermolecular.
Dissociação iônicaNesse caso, em que já existiam íons e apenas os separamos, chamamos o processo de dissociação iônica, pois tudo o que fizemos, repito, foi separar íons pré-existentes. É o que acontece com os sais e as bases.
NaCl = Na+ + Cl-
CaCO3 = Ca2+ + CO32-
NaHCO3 = Na+ + HCO3-
LiOH = Li+ + OH-
Al(OH)3 = Al3+ + 3OH-
Importante: Compostos iônicos sofrem dissociação quando em solução e quando fundidos.
IonizaçãoAlguns compostos moleculares, como os ácidos, quando colocados em um solvente são "atacados" por esse solvente e acabam formando íons. Perceba claramente que não existiam íons na molécula original. Quando ela foi colocada na presença do solvente, este conseguiu, por força magnética, "arrancar" um ou mais de seus átomos mas, nesse processo, o átomo arrancado acaba tendo que deixar um elétron para trás, tornando-se um íon.
Nesses casos, dizemos que houve uma ionização, pois uma molécula que não possuía originalmente íons passa a tê-los (livres no solvente). É o que acontece com os ácidos.
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
H3CCOOH = H+ + H3>CCOO-
Importante: Substâncias moleculares que sofrem ionização só o fazem quando em solução. O processo não ocorre quando essas substâncias estão fundidas.
O que você deve lembrar
Sais e bases: por serem compostos iônicos, sofrem dissociação quando em solução ou fundidos.
Ácidos: por serem compostos moleculares, sofrem ionização quando em solução.
A dissociação ou ionização é de grande importância para o favorecimento da ocorrência de reações. É muito mais fácil promovermos reações com íons livres do que com moléculas agrupadas. Talvez seja por isso que, na sábia natureza, a esmagadora maioria das reações químicas - inclusive no nosso corpo - aconteçam em solução. Além disso, íons livres permitem a passagem de corrente elétrica, o que, em casos como neurotransmissores é absolutamente fundamental.
Estude um pouco
Para você não errar nas equações de dissociação e ionização, é importante conhecer a valência dos íons. Não sugiro que você passe o resto do ano decorando uma tabela iônica, mas tê-la por perto e consultá-la constantemente quando resolver exercícios fará com que se você habitue aos mesmos e os "decore" naturalmente, de tanto utilizá-los. Esta é a grande importância de - além de entender os conceitos -treinar resolvendo exercícios.
* Fábio Rendelucci é professor de química e física e diretor do cursinho COC-Universitário de Santos (SP).
Reações Químicas
O que é uma Reação Química?
Uma reação química é uma alteração química onde matéria (um reagente ou reagentes) se convertem em uma nova substância ou substâncias (um produto ou produtos). Algumas reações ocorrem somente sob determinadas circuntâncias (ex., fornecimento de calor, presença de luz ou eletricidade). Algumas reações são acompanhadas de indicações externas (ex., mudança de cor, desprendimento de gás, calor ou luz).
Quais são os tipos importantes de Reações Químicas?
- Reação de Síntese ou Combinação Direta é a reação onde duas ou mais substâncias se combinam diretamente para formar um novo composto químico.
Fórmula Geral: A + B ---> AB
Exemplo: Fe + S ---> FeS
i.e., Ferro + Enxofre ---> Sulfeto de Ferro - Reação de Decomposição é a reação onde um composto químico se quebra (decompõe) em duas ou mais substâncias. Se a decomposição requer uma fonte de calor, a mesma é chamada decomposição térmica.
Fórmula Geral: AB ---> A + B
Exemplo: ZnCO3 ---> ZnO + CO2
i.e., Carbonato de Zinco (+ Calor) ---> Óxido de Zinco + Dióxido de Carbono - Reação de Simples Troca é a reação onde um elemento substitui outro em um composto químico para produzir um novo composto e o elemento deslocado.
Fórmula Geral: A + BC ---> AC + B
Exemplo: Fe + CuSO4 ---> FeSO4 + Cu
i.e., Ferro + Sulfato de Cobre ---> Sulfato de Ferro + Cobre - Reação de Dupla Troca é a reação onde dois compostos químicos trocam seus radicais para formar dois novos compostos.
Fórmula Geral: AB + CD ---> AD + CB
Exemplo: KCl + AgNO3 ---> KNO3 + AgCl
i.e., Cloreto de Potássio + Nitrato de Prata ---> Nitrato de Potássio + Cloreto de Prata











0 comentários:
Postar um comentário